
Casetas con las unidades de emergencias a las afueras del Centro Medico para atender personas y hacer pruebas de COVID-19. (Foto de Eric Rojas | Centro de Periodismo Investigativo)
por Luis J. Valentín Ortiz y Cristina del Mar Quiles
SAN JUAN, Puerto Rico — El proceso de compras del Gobierno de Puerto Rico de materiales y equipo para enfrentar la emergencia del coronavirus ha estado plagado de errores, retrasos, ineficiencia, compras cuestionables y falta de detalles.
Más de tres fuentes entrevistadas por el Centro de Periodismo Investigativo (CPI) identificaron a Adil Rosa Rivera como la persona responsable formalmente de la compra de suplidos para la emergencia, como ventiladores, pruebas y equipo de protección. Hasta hace unos días, Rosa Rivera coordinó el proceso de compras, primero desde Salud y luego en el Centro de Operaciones (COE) del Negociado de Manejo de Emergencias (NMEAD). Desde el COE, junto a los miembros del Task Force médico, el Dr. Juan Salgado y el Dr. Segundo Rodríguez, han coordinado qué comprar y a quién se le compra, aseguraron tres fuentes.
Adil Rosa Rivera, quien trabajó anteriormente como directora de Administración de la región de Caguas del Departamento de la Familia, tuvo a su cargo la secretaría auxiliar de Administración del Departamento de Salud hasta la semana pasada. Llegó a la agencia durante la incumbencia del exsecretario, Rafael Rodríguez Mercado, y su chief of staff, Mabel Cabeza Rivera.
Dos fuentes identificaron a Cabeza como la persona que La Fortaleza designó para supervisar las compras que manejaba Adil Rosa Rivera y el Task Force desde Salud y el COE.
“Fui nombrada en destaque para laborar en La Fortaleza. Ahí se me solicitó que trabajara con el Task Force en Fortaleza dirigido por el Dr. Segundo Rodríguez. No se me brindó un título o tareas en específico. […] No fui ni enlace ni coordinadora” reaccionó por escrito Cabeza, quien salió de Salud el 30 de marzo para pasar a la mansión ejecutiva.
Añadió: “Nunca he tenido rol alguno en cuanto al proceso de compras o contrataciones de Salud, de Fortaleza ni del proceso de Emergencia”.
Pero las fuentes aseguran que Cabeza era el enlace entre la mansión ejecutiva y el Task Force médico hasta el 30 de marzo, y refirió nombres de compañías a Rosa Rivera para que se les pidiera cotización. Varias empresas referidas por La Fortaleza lograron vender sus productos al Gobierno, incluyendo las tres compañías que suplieron pruebas rápidas a Salud: Zogen (cuyo representante autorizado en la isla es 313 LLC), Castro Business y Maitland 175 Inc. Antes del cierre de cualquier transacción, el proceso incluye la revisión de la Oficina de Gerencia y Presupuesto (OGP), el Departamento de Hacienda y la secretaría del Departamento de Salud.
Cabeza negó que diera instrucciones o sugerencias a Rivera Rosa en cuanto a suplidores. “Cualquier email o mensaje de texto de propuestas que a mí me llegaban se les enviaba al Departamento de Salud para que fuesen ellos quienes evaluaran y tomaran sus determinaciones. NUNCA emití recomendación alguna sobre ninguna persona o entidad jurídica con respecto a la compra de pruebas o cualquier otra adquisición que estaba bajo consideración del Task Force”, dijo.
Las fuentes añadieron que los acercamientos de suplidores que recibe el Gobierno y el Task Force durante la emergencia se han canalizado a través de Adil Rosa Rivera, quien a su vez pide cotizaciones según las exigencias del grupo de médicos, particularmente a través del Dr. Salgado y el Dr. Rodríguez. Aunque el Task Force asegura que su rol se limita a recomendar qué se necesita y evaluar las opciones disponibles, más de tres fuentes aseguran que tanto el Dr. Rodríguez, como el Dr. Salgado tienen poder decisional e imparten instrucciones de compra.
Cabeza identificó a Adil Rosa Rivera, la Dra. Quiñones de Longo y el Dr. Segundo Rodríguez como las personas responsables del proceso de evaluación y contratación. “Yo no participaba de las reuniones de compras y/o contratación que se llevaron a cabo entre ellos”, aseguró.
El CPI supo que Rosa Rivera fue entrevistada por autoridades federales con relación a las compras realizadas. Rosa es activista del Partido Nuevo Progresista (PNP) y en sus redes sociales ha mostrado su apoyo al partido, la gobernadora Wanda Vázquez Garced y al exmandatario, Ricardo Rosselló Nevares, entre otras figuras relacionadas al PNP. Según una fuente, entre Mabel Cabeza y Adil Rosa existe una amistad, pero según Cabeza, la relación es una profesional.
Rosa Rivera fue designada por los tres secretarios que ha tenido el DS en el pasado mes para supervisar el proceso de compras de parte de la agencia. Un boletín interno de la agencia el 3 de abril anunció la designación de Johnny Colón González al puesto de secretaría auxiliar de Administración, pero no queda claro si Rosa Rivera continúa trabajando en Salud. La agencia no contestó si fue removida o si sigue involucrada en el proceso de compras.
El CPI intentó contactar a Adil Rosa pero no tuvo éxito.
El Dr. Salgado admitió en entrevista con el CPI su intervención en el proceso de compras desde el COE y negó que recomendara a compañías de amigos o conocidos, aunque sí refirió a suplidores que lo han contactado. Una petición de entrevista al Dr. Rodríguez Quilichini no fue atendida.
Al menos tres fuentes dijeron que La Fortaleza ha intervenido directamente en el proceso de compras, principalmente a través de Mabel Cabeza, cuando ella supervisaba desde la mansión ejecutiva las compras que realizaba Rosa y el grupo de Salud.
La Gobernadora reiteró el miércoles que La Fortaleza no intervino en el proceso de compras, incluyendo la orden de un millón de pruebas rápidas que fue cancelada. Nombró como responsable al Departamento de Salud.
El CPI preguntó a la exsecretaria de Salud, Dra. Concepción Quiñones de Longo, si las órdenes de compra que realizó Salud bajo su incumbencia se estaban gestionando desde La Fortaleza.
“Eso es correcto, las compras y las cotizaciones las gestionaban desde La Fortaleza y nos contactaban solo para firmar el visto bueno. Los procesos yo entendía que no eran los adecuados, que eso fue lo que motivó al fin y al cabo mi renuncia, porque yo no estaba dispuesta a participar de todo ese tipo de compra, porque yo entendía que no eran lo mejor para el Departamento de Salud y el Gobierno”, contestó.
Cabeza afirmó al CPI: “No tuve nada que ver con el proceso de compras ni adjudicación”.
Quiñones de Longo aprobó la compra de pruebas y otros materiales para la emergencia realizadas cuando estuvo a cargo de la agencia. Dos fuentes aseguran que la doctora evaluaba estas órdenes y tenía una persona del los Centros para el Control de Enfermedades (CDC) que la asistía.
La compra de materiales y equipo se hizo desde Salud hasta el 26 de marzo. Ese día, NMEAD tomó control del proceso, pero solo en papel, según dijo el jefe del Negociado, José Burgos, a El Nuevo Día. Burgos identificó a Adil Rosa como la persona que dio la instrucción de compra de un millón de pruebas rápidas que fue cancelada la semana pasada. Una entrevista solicitada a Burgos no fue concedida.
El suplidor de estas pruebas, Apex, ya había enviado una cotización, antes de que se le pidiera desde el COE. El CPI vio evidencia de que la cotización de la compañía había sido enviada con anterioridad por Juan Maldonado, exdirector de la Autoridad de Transporte Marítimo y abogado de Apex, a tres personas: el Dr. Segundo Rodríguez, el Dr. Roberto Rosso —ayudante de Quiñones de Longo y quien renunció tras la salida de la exsecretaria— y Mabel Cabeza Rivera.
Además, la evidencia también muestra que Eduardo “Tito” Laureano, vinculado al PNP y quien trabajó para Pedro Rosselló, ayudó a establecer el contacto entre el Task Force y el abogado de Apex, Maldonado. Laureano, quien fue contratado por el Dr. Segundo Rodríguez en el Recinto de Ciencias Médicas según reportó Metro, es amigo del Dr. Rodríguez, dijo una fuente.
En una conferencia de prensa el miércoles, el Dr. Rodríguez evadió contestar directamente su relación con Laureano, pero aceptó recibir de él la información de contacto de Maldonado y Apex.
Otra fuente dijo que el Dr. Salgado mantiene una estrecha relación de amistad con el padre de Juan Maldonado, abogado de Apex.
Cabeza, por su parte, aseguró no conocer a nadie relacionado a la compañía APEX. “Nunca recomendé a esta compañía o a cualquier otra. Nunca solicité propuesta de ninguna de las compañías contratadas por Salud ni por el NMEAD ni recomendé a ninguna”.
La adquisición de pruebas para detectar el coronavirus muestra las irregularidades y tropiezos que ha tenido el proceso de compras en el Gobierno para enfrentar la epidemia. De las primeras pruebas que llegaron a Puerto Rico el pasado 17 de marzo —200 pruebas moleculares o “PCR” de la compañía Quest—, el Departamento de Salud proveyó evidencia de entrega para todas estas pruebas, excepto las 50 que fueron al aeropuerto. Según la agencia, fueron entregadas a una empleada de la Administración de Servicios Médicos para el Aeropuerto Luis Muñoz Marín. Estas son las pruebas que, según Concepción Quiñones de Longo, fueron entregadas sin cumplir con la cadena de mando.
La persona responsable de la custodia de pruebas era Adil Rosa, según afirmó Mabel Cabeza Rivera. Una fuente asegura que Rosa Rivera no tenía todavía la responsabilidad de custodiar las pruebas al momento que llega esa entrega, el 17 de marzo.
Una petición de todas las órdenes de compra realizadas durante la emergencia por Salud y NMEAD no fue atendida.
Las pruebas “rápidas”
Adicional a las pruebas “PCR”, el Gobierno compró a sobreprecio alrededor de 1.3 millones de pruebas serológicas o “rápidas”, otro tipo de prueba, que detecta anticuerpos al COVID-19. Las compras fueron gestionadas entre Salud y NMEAD, y al momento de la compra, ninguna de las marcas contaba con el aval de la Administración Federal de Alimentos y Medicamentos (FDA). Varios de los vendedores tienen vínculos al PNP.
Adil Rosa, el Task Force y la oficina del secretario de Salud dieron su visto bueno a la compra de pruebas de parte de Salud, dijeron tres fuentes por separado. La compra del millón de pruebas de NMEAD fue decidida por el Task Force, dijo una fuente, ante la ausencia de un secretario de Salud nombrado en ese momento.
El miércoles, la Gobernadora dijo que fue Mariel Rivera, empleada de compras de Salud destacada en el COE. Pero Rivera no tiene autoridad para avalar transacciones de compra, indagó el CPI.
De la cantidad total de pruebas rápidas adquiridas por el Gobierno, NMEAD compró un millón de pruebas marca Promedical, a $38 cada una, para un total de $38 millones, casi un 200% mayor al valor del mercado en ese momento, según fuentes y documentos consultados por el CPI. Tras pagar la mitad de la factura por adelantado, el Gobierno aseguró que canceló esta orden porque la compañía no cumplió con el tiempo estipulado para la entrega de pruebas y porque no cumplían con regulaciones de la FDA, y obtuvo el dinero de vuelta. Esta compra fue a la compañía APEX, cuyo dueño, Robert Rodríguez López, también tiene vínculos con el PNP y con 313 LLC, según reportó El Nuevo Día.
En declaraciones escritas, el socio fundador de 313 LLC, Ricardo Vázquez Hernández, negó tener relación con Rodríguez López y la compañía Apex.
Pero lo que no ha dicho el Gobierno es que existen más de 100,000 pruebas rápidas adquiridas por Salud a la empresa 313 LLC, que al igual que ocurrió con NMEAD y las pruebas de Promedical, Salud pagó a sobreprecio. La compañía 313 LLC fue registrada en Puerto Rico en el 2018 por Ricardo Vázquez Hernández, quien dos días antes realizó cambios a su certificado de formación para incluir tres nuevos socios: Juan Suárez Lemus, Wilfredo Rodríguez Moreno y Miguel García Robles, reportó el sábado Caribbean Business, además de que Suárez Lemus y Vázquez Hernández son donantes del PNP.
El CPI encontró que Vázquez Hernández también aparece como dueño de Vertical Consulting PSC. Esta última es una firma de asesoría legal, según el contrato de incentivos contributivos que Vázquez Hernández recibió en el 2019 de la Compañía de Comercio y Exportación como joven empresario bajo un programa de creación de empresas.
Las cerca de 100,000 pruebas NovaTest se compraron entre $45 y $26, a pesar de que había otras opciones similares en el mercado a un costo menor. Salud pagó por adelantado más de $2.2 millones.
En conferencia de prensa, la gobernadora se desligó del proceso de compra. Dijo que personas se le acercaron a ella y a miembros del Task Force para ofrecerles pruebas rápidas y que se refirieron a Salud. “Se pidieron cotizaciones y estas personas sometieron”, dijo sin especificar quién fue la persona que hizo el primer acercamiento.
“Puede que no tenga conocimiento del detalle, pero todo esto se discutió en las múltiples reuniones que tuve… La Gobernadora no puede ir al micromanagement y yo confío en mis funcionarios”, dijo para excusar su desconocimiento del asunto.
Además, justificó las compras a sobreprecio por la demanda internacional del producto, aunque reconoció que tampoco sabía cuál sería el margen de ganancia de las compañías a las que se les hizo la orden.
El precio en el mercado para este tipo de prueba y en esta fecha, fluctúa entre los $13 y los $20, según confirmó el presidente del Asociación de Laboratorios Clínicos de Puerto Rico, Juan Rexach.
“Estoy seguro de que si compras en grandes cantidades, se puede negociar un mejor precio”, apuntó el doctor en medicina y licenciado en tecnología médica.
Las dos órdenes de compra de NovaTest nunca fueron canceladas, según confirmó este martes el secretario González al CPI, aunque no fue hasta ese mismo día que la prueba entró a la lista de la FDA como una que se ha validado independientemente para la identificación de anticuerpos al COVID-19, pero que no ha sido revisada por la FDA.
En la entrevista, González dijo que desconocía de las pruebas NovaTest.
Las órdenes de compra de Salud muestran a Vázquez Hernández de 313 LLC como persona contacto de una compañía de nombre “ZOGEN”, quien según él, es la distribuidora autorizada en América de la manufacturera de NovaTest, la compañía china Atlas Link. Zogen es una compañía mexicana que tiene a Vázquez Hernández como su persona contacto en Puerto Rico.
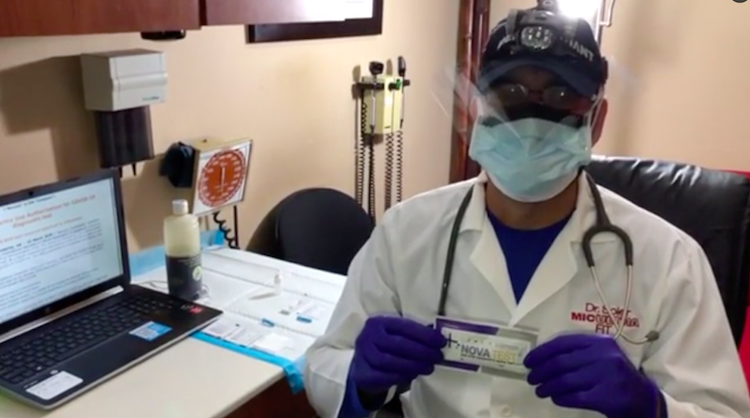

El Dr. Michael Soler
El Dr. Michael Soler dijo hace una semana a El Nuevo Día que el Gobierno ya había recibido más de 1,000 pruebas NovaTest y que 500 más “venían de camino”. La cantidad coincide con las 1,500 pruebas NovaTest de la primera orden hecha a 313 LLC. Soler añadió que Zogen envió dos muestras de su producto, una a él y la otra a Salud. La agencia habría usado su muestra durante una conferencia de prensa, según Soler, quien usó la suya en este video demostrativo para El Nuevo Día en el cual se puede apreciar en la pantalla de la computadora una autorización de la FDA que no corresponde a la prueba NovaTest, sino a otra prueba realizada por una empresa de nombre Novacyt.


El galeno no contestó una petición de entrevista.
El CPI encontró que desde el 28 de marzo, Salud ya había recibido y distribuido casi 1,000 pruebas NovaTest a hospitales alrededor de la isla, sin que tuvieran el visto bueno de la FDA. Salud no pudo precisar el paradero de las pruebas NovaTest que se han repartido.
Hasta el sábado en la tarde, aunque se habían distribuido más de 2,000 pruebas, el Gobierno no había realizado ninguna de estas pruebas rápidas, según dijo el secretario de Salud, Lorenzo González en conferencia de prensa.
Al pedir un desglose de las pruebas rápidas recibidas y entregadas, el Secretario dijo que entregaría un informe con los resultados. “Tiene que existir en el Departamento”. Ese informe no ha sido entregado al CPI.
González aseguró que a su llegada, el proceso de compras cambió, incluyendo tener más de una cotización para cada orden, buscar la evaluación de agencias federales antes de la compra y evitar el uso de intermediarios.
Sin brindar mayores detalles, González sostuvo que referiría este martes a las autoridades pertinentes todo lo que ha encontrado sobre el proceso de compras llevado a cabo en la agencia. El Departamento de Justicia anunció que comenzó una pesquisa limitada a las pruebas rápidas adquiridas por NMEAD a la compañía Apex. La Junta de Control Fiscal también pidió revisar las órdenes de compra de pruebas rápidas ya que no pasaron por su cedazo.
González dijo al CPI que pidió este martes una reunión con la Junta para entender el proceso que ellos piden, “reconociendo que ellos tienen injerencia” en el proceso y que añadirá sus requisitos al proceso de compras en la agencia.
Las más de 300,000 pruebas rápidas adquiridas desde Salud fueron aprobadas por la entonces Secretaria, la Dra. Concepción Quiñones de Longo, según dos fuentes.
Aunque la Gobernadora implicó que los exsecretarios Rafael Rodríguez Mercado y Quiñones de Longo fueron los únicos responsables por la compra fallida de pruebas rápidas, la única orden de compra que ha sido cancelada hasta la fecha fue autorizada y firmada a través de NMEAD y no por Salud.
“Por eso se crea la controversia, porque yo no estaba de acuerdo con lo que se estaba haciendo. Bastante mal que me trataron queriéndome obligar a hacer cosas con las que yo no estaba de acuerdo”, añadió la doctora, quien dijo que colabora con distintas investigaciones relacionadas a estas compras.
A sobreprecio y a personas vinculadas al PNP
Además de las pruebas NovaTest, Salud compró 50,000 pruebas rápidas a un segundo vendedor, Castro Business. A un costo de $13 por cada prueba, es la única transacción realizada a precios consistentes con el valor del mercado.
Castro Business está registrada en Puerto Rico a nombre de Ricardo “Ricky” Castro Ortiz, expresidente de MIDA y también donante del PNP. Castro fue señalado por la Oficina del Contralor en el 2017 por irregularidades en dos contratos multimillonarios con la Guardia Nacional. El Gobierno ya recibió y repartió una cantidad de estas pruebas antes de que recibieran el visto bueno de la FDA.
El CPI intentó contactar por teléfono a Castro Ortiz sin éxito.
Este medio preguntó a Salud por el estatus de estas 50,000 pruebas, pero no recibió respuesta.
En entrevista con el CPI, González dijo: “Te puedo hablar de la semana pasada, de lo que nos hemos encontrado. Nos llegaron alrededor de 7,000 pruebas, llegaron el viernes pasado. La compañía, no tengo el detalle. Sí llegaron a Puerto Rico implicando que pasó a Aduanas. Sí hubo una preocupación de la FDA, con la parte de regulación”.
El funcionario explicó que la FDA pidió cambios a las etiquetas e instrucciones de esta prueba antes de poder ser utilizadas. Añadió que 200,000 pruebas adicionales llegaron el domingo y que la entrega final se completó el lunes, luego de recibir el visto bueno de la agencia federal. No queda claro si estas son las adquiridas por Salud a Maitland 175 Inc, una compañía de Florida con una orden de compra por la misma cantidad.
El CPI encontró que dos de las manufactureras de pruebas rápidas son Healgen, otra compañía china y Phamatech, una compañía de California. Ambas figuran en el registro de la FDA.
FDA advierte sobre información errónea
Parte del retraso en realizar pruebas del coronavirus en Puerto Rico se debe a que hasta ahora se ha descansado en las pruebas moleculares y no en las pruebas serológicas, o “rápidas”, que pueden tomar minutos en arrojar el resultado. Sin embargo, la prueba rápida es menos confiable que la molecular ya que solamente da positivo si identifica anticuerpos contra el virus. Esto eleva la posibilidad de falsos positivos o negativos en personas que no tengan síntomas a pesar de que tengan la enfermedad, contrario a las moleculares.
“Las pruebas serológicas jugarán un papel importante en investigación y vigilancia pero no son actualmente recomendadas para detección de casos”, establece la Organización Mundial de la Salud (OMS) en sus Recomendaciones de estrategia de pruebas de laboratorio para COVID-19.
Las pruebas moleculares de los laboratorios Quest y LabCorps, que suplen a municipios y al Departamento de Salud, figuran en la lista de la FDA.
La política de diagnóstico de la FDA permite que se usen las pruebas sin autorización de la FDA, siempre que estén etiquetadas apropiadamente, incluyendo una declaración de que no pueden usarse como la única base para diagnóstico o exclusión de infección.
La agencia federal ha sido enfática en que las pruebas que no han recibido una autorización de uso de emergencia, como las adquiridas por el Gobierno de Puerto Rico, no pueden anunciarse como “autorizadas” porque “no lo están”.
Ante la emergencia por COVID-19, la FDA viabilizó que “productos médicos no aprobados, o usos no aprobados de productos médicos aprobados”, se utilicen para diagnosticar, tratar o prevenir enfermedades graves cuando no existen alternativas adecuadas, aprobadas y disponibles a través de una Autorización de Uso de Emergencia. Solo los CDC, los laboratorios públicos de Nueva York y unas 28 compañías cuentan con tal autorización para sus pruebas de detección de la COVID-19.
Según ha ido progresando el ritmo de contagios en Estados Unidos, la FDA emitió el 16 de marzo una nueva “Política de pruebas de diagnóstico para enfermedad por coronavirus-2019 durante la emergencia de salud pública”, en la que establece que no objetará el desarrollo, distribución y uso de pruebas serológicas para identificar anticuerpos contra el SARS-CoV-2, también conocidas como pruebas rápidas. Establece, sin embargo, que la prueba debe ser validada por el laboratorio donde se va a administrar e incluir la advertencia de que no ha sido revisada por la FDA y que no debe usarse como la única base para diagnosticar o excluir la infección con el virus.
Según el presidente de la Asociación de Laboratorios Clínicos de Puerto Rico, no existe en Puerto Rico un proceso de validación uniforme para las pruebas rápidas. Las Enmiendas de Mejora del Laboratorio Clínico (CLIA en inglés), que son estándares que se aplican a las pruebas de laboratorio clínico realizadas en humanos en los Estados Unidos, ofrecen guías para validar pruebas que no han sido aprobadas por la FDA. Establecen que se debe utilizar la prueba que se quiere validar en entre cinco y diez pacientes que hayan arrojado positivo en la prueba molecular (PCR), y la misma cantidad de pacientes que hayan tenido resultado negativo.
“Así, confirmo que las pruebas están funcionando, pero además, ese proceso hay que documentarlo y ese proceso tarda”, señaló Rexach. Por eso, señaló, tan pronto llega una entrega de pruebas, cada hospital, clínica y laboratorio que las recibe, tiene que bloquear unas 20 para completar este proceso antes de utilizarlas en la población general para la que han sido designadas.
Una fuente de la industria indicó que el proceso de validación puede tomar unos tres días desde el momento en que el laboratorio recibe la prueba.
Omaya Sosa Pascual y Rafelli González colaboraron en esta historia.



[…] Versión original en español aquí. […]